
ENZYMOLOGIE. VOCABULAIRE
| French
|
Arabic
|
English
|
| Cinétique des enzymes | حركية الإنزيمات | Enzyme kinetic |
La cinétique des enzymes (حركية الإنزيمات, Enzyme kinetic) permet de définir leurs types et comprendre leurs mécanismes de catalyse.
Le processus de catalyse enzymatique commence par la liaison du substrat (S) à l'enzyme (E) pour former temporairement un complexe enzymatique ou complexe enzyme-substrat (ES). Le complexe ES est ensuite décomposé en produits (P) avec libération de l'enzyme (E), comme le montre le schéma ci-dessous. Des études ont montré que le complexe ES est converti en un autre complexe enzymatique avec les produits (complexe EP) avant que les produits eux-mêmes ne soient libérés. Par souci de simplicité, nous ne considérerons pas le complexe EP dans les premières explications, car il se transforme à grande vitesse en produits. Dans des conditions physiologiques, de nombreuses réactions enzymatiques existent dans un état réversible (capacité à obtenir des substrats et des produits à l'équilibre). Cependant, il existe d’autres réactions enzymatiques qui ne sont pas réversibles par nature, ce qui signifie qu’il devient difficile de reconstituer les substrats lors de la réaction. La vitesse initiale de l'enzyme est coincide avec l'apparition des produits (P) en faibles concentrations car la réaction se déroule dans un seul sens (irréversibilité). Il est donc possible de calculer l'équation de vitesse de la réaction et déterminer les paramètres cinétiques de l'enzyme qui sont représentés par la constante de Michaelis (Km) et la vitesse maximale (Vmax) de l'enzyme.
Formation de complexe enzyme-substrat (ES)
La catalyse enzymatique d'une réaction biochimique s'effectue par formation de complexe Ensyme-Substrat (complexe E-S).

L'existence de ce complexe peut être démontrée par plusieurs preuves expérimentales comme la dialyse à l'équilibre, la filtration sur gel, la spectrographie, la cinétique rapide et la cristallisation du complexe, lui même.
Des produits de la réaction résultent de la formation du complexe E-S. La vitesse d'apparition des produits (V) fait l'objet de la cinétique enzymatique. Celle ci peut être 'hyperbolique' (ou Michaellienne, MICHAELLIS, 1902) ou sigmoïde (ou allostérique) lorsqu'elle est étudiée en fonction de la concentration en substat (S).

EXPRESSIONS DE L'ACTIVITE ENZYMATIQUE
Il existe plusieurs façons d'exprimer l'activité enzymatique. On peut citer:
katal (kat), unité officielle (pratique medicale), quantité d'enzyme qui catalyse la transformation de 1 mole de substrat par seconde. Le katal n'est jamais utilisé, car beaucoup trop grand. On doit utiliser des sous-unités comme les µkat (10-6 katal), nkat (10-9 katal), unité usuelle ou pkat (10-12 katal).
unité internationale
(IU, International Unit), utilisée par la plupart des biochimistes. Elle correspond à la quantité d'enzyme qui catalyse la transformation de 1 µmole de substrat par minute dans les conditions optimales du dosage. 60 IU valent donc 1 µkat.
Activite specifique moléculaire (ASM) : nombre de moles de substrat transformé par mole d'enzyme et par seconde. ASM est une caracteristique de l'enzyme.
Elle ne peut être calculée que si la préparation enzymatique est pure. ASM correspond a la constante catalytique (kcat), nombre de rotations ou turn over de la reaction et s'exprime en seconde-1. ....Exercice sur expression
de l'activité.
Le nombre de rotations (kcat) est le nombre de molécules de substrat transformées par molécule d'enzyme par seconde (ou le nombre de moles de substrat transformé par mole d'enzyme.
Activité molaire
est le nombre de moles de substrat transformé par mole d'enzyme par minute (kcat x 60).
Activité spécifique
Sans connaître le poids moléculaire de l'enzyme, on peut quand même mesurer l'activité spécifique (AS) , soit l'activité par mg de protéine
purifiée. Normalement, elle est donnée en IU/mg protéine (ou µkat/mg).
Si on calcule l'activité spécifique sur un extrait non-purifié (soit un mélange de protéines), elle indique la pureté d'une enzyme.
Au cours d'une purification d'enzyme, on mesure régulièrement:
l'activité totale (IU ou µkat), la quantité totale de protéines (mg) et le volume total de solution (ml).
De ces trois valeurs, on peut calculer: AS et le rendement (activité totale / activité totale avant la première étape de purification) et le taux de purification (activité spécifique / activité spécifique
avant la première étape de purification).
L'activité spécifique et le taux de purification atteigne une valeur maximale lorsque l'enzyme est pure.
Peut-on bloquer une réaction enzymatique in vivo ou in vitro? Comment?
Bien sûre. On peut le faire par plusieurs procédures dont l'utilisation d'inhibiteurs qui peuvent être ou non des analogues structuraux des vrais substrats de l'enzyme. Selon les types de complexes qu'ils forment en présence de l'enzyme et/ou du substrat et la modification de la cinétique qu'ils entraînent, les inhibiteurs sont qualifiés de 'compétitiffs', 'incompétitifs', 'non compétitifs' ou 'mixtes'.
EXEMPLES
D'APPLICATION DES INHIBITEURS.
1/ Les sulfamides (antibiotiques): analogues structuraux de l'acide p-aminobenzoïque, substrat d'enzymes bactériennes synthétisant l'acide folique, coenzyme nécessaire pour la croissance bactérienne.
2/ Les médicaments du traitement du SIDA.
Une réaction catalysée par une enzyme comprend au moins trois réactions simples pouvant être représentées par l'enchaînemenr réactionnel suivant:
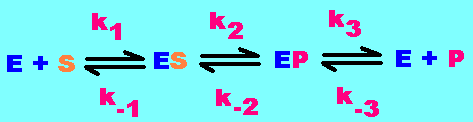
Fixation du substrat (S) sur l'enzyme (E), formation du complexe (ES), Transformation du substrat fixé (ES) en produit (EP), Dissociation du complexe (EP) et Libération du produit (P).
La vitesse de réaction est difficile à mesurer en présence de S et P, surtout à l'équilibre!
On mesure de préférence la 'vitesse initiale':
Au début de réaction, P n'est pas encore formé, et on présume que le complexe EP se dissocie plus vite qu'il ne se forme à partir de ES, c'est-à-dire que k3 > k2, k-2 (voir schéma explicatif en haut). La réaction k2 est limitante de la formation de P. Dans ces conditions, le schéma se simplifie.
Leonor Michaelis et Maud Menten (1912) ont déduit de ce modèle une équation qui prédit la vitesse initiale (de formation de P) en fonction de la concentration du substrat:
Vitesse initiale de la réaction: vi = d[P]/dt = k2·(ES)
La vitesse de réaction dépend de la concentration du complexe enzyme-substrat ES dont il faut l'évaluer:
ES se forme à partir de E + S et se décompose soit en E + S , soit en E + P .
Vitesse de formation de ES: vf = k1·(E)·(S)
Vitesse de dissociation de ES: vd = (k-1+ k2)·(ES)
(ES) atteint rapidement une valeur constante (condition dite de "steady
state"),
donc: vf = vd
k1·(E)·(S) = (k-1+ k2)·(ES)
(ES) = (E)·(S).k1/ (k-1+ k2), soit Km
= (k-1+ k2) /k1 appellée constante de Michaelis-Menten,
(ES)= (E)·(S) / Km (equation 1)
La vitesse initiale vi = k2.(ES), la vitesse maximale est obtenue lorsque toute l'enzyme est complexée sous forme 'enzyme totale' (ET). Donc: (ES) = (ET) et Vmax = k2.(ET)
Faisons le rapport vi/Vmax: vi/Vmax = (ES)/(ET) avec (ET) = (E) + (ES)
vi/Vmax = (ES)/[(E)+(ES)] (equation 2)
En remplaçant (E) par sa valeur déduite de l'équation 1 ((E) = (ES).Km/(S)), on trouve:
vi/Vmax = (ES)/[(ES).Km/(S) + (ES)] = 1/[1 + Km/(S)], soit vi = Vmax.1/[1 + Km/(S)] qui peut être écrite:
vi = Vmax. (S)/[(S) + Km]
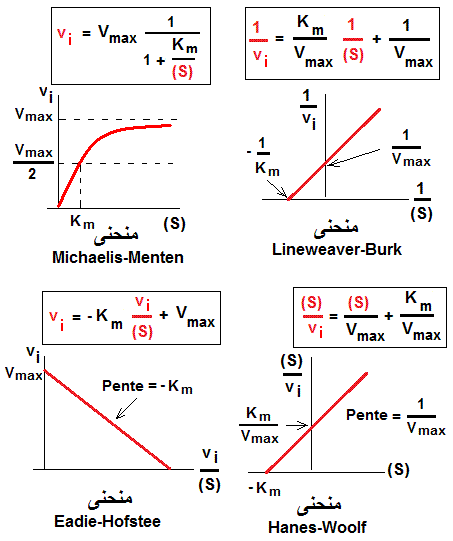
REPRESENTATIONS GRAPHIQUES DE LA CINETIQUE MICHAELIENNE

Cas
spéciaux ou extrêmes: (S)>> Km, vi = Vmax·(S)/(S), vi = Vmax; vi indépendente de (S), saturation, asymptote 1
(S)<< Km, vi = Vmax·(S)/Km, dépendence
linéaire de (S), substrat limitant, asymptote 2.
(S)= Km, vi = Vmax· Km / 2 Km, vi = Vmax / 2, demi-saturation
de l'enzyme.
Vmax est la vitesse maximale que peut atteindre la réaction lorsque l'enzyme est saturée de substrat,
c'est-à-dire lorsque (ET) = (ES).
Km est la concentration de substrat qui sature l'enzyme à moitié.
C'est une mesure de l'affinité de l'enzyme pour le substrat: plus l'affinité est élevée, plus Km est petit.
k2 (= Vmax/(ET)) est souvent appelée constante
catalytique kcat.
Le rapport kcat/Km est souvent donné comme mesure de l'efficacité
catalytique, car il correspond à une constante de vitesse pour de basses concentrations de substrat (S) << Km, donc (E) = (ET)
vi= Vmax· (S)/ Km = kcat·(E)·(S)/ Km = (E)·
(S)· kcat/Km
Linéarisation de l'équation de Michaelis-Menten
Une hyperbole est difficile à tracer manuellement. Des erreurs sur l'estimation de la Vmax sont possibles.Pour simplifier la représentation graphique de l'équation de Michaelis-Menten, on transforme l'hyperbole en droites de différentes équations (changement des axes). L'exemple en est la transformation de Lineweaver et Burke:
1 / vi = 1 / Vmax + (Km / Vmax )· 1 /(S). Cette équation représente une droite de pente Km / Vmax
L'intersection sur l'axe vertical est 1 / Vmax et sur l'axe horizontal -1 / Km . A côté de cette représentation, il existe plusieurs autres, dont la représentation Eadie-Hofstee et la représentation
de Hanes-Woolf (figure ci dessous).
 |
 |
 |
INHIBITION PAR EXCES DE SUBSTRAT
Dans de plusieurs enzymes, le substrat peut former des complexes du type ESS, non réactifs du fait que le substrat est incorrectement disposé dans le site actif. L'inhibition par excès de substrat est analogue à celle exercée par un inhibiteur (I) conditionnel (inhibiteur incompétitif), en remplaçant I par le substrat (S). Le complexe ESS n'est pas productif (figure ci dessous). KS et Vmax diminueront d'un facteur (1 + (S)/KI). Ils seront tous divisés par le même facteur et l'équation de vitesse deviendra comme ci dessous:
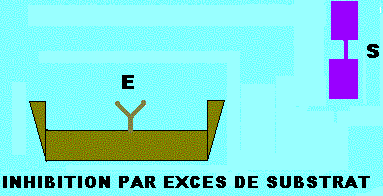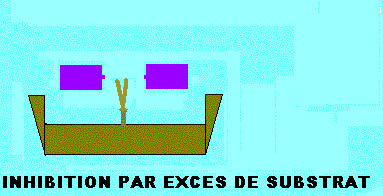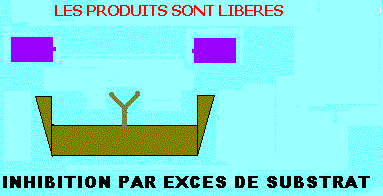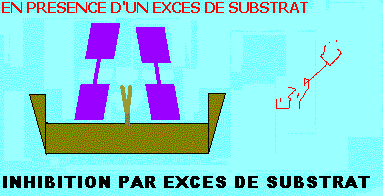
Equation de vitesse de l'inhibition par excès de substrat et représentations graphiques
VIDEO Enzymes catalyseurs biologiques.

Afin d'encourager les illustrations vidéos des cours et données en biochimie, faite acquisition des livres de la préparation de la transition Secondaire-Supérieur et trouver toutes les vidéos sur les DVD accompagnant les ouvrages.
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
