

LIPIDES. INDICES
Les lipides (الدهنيات) sont classés sous plusieurs catégories dont les lipides à acides gras (lipides saponifiables, دهنيات مصبنة) dont les triglycérides (الجليسيريدات الثلاثية). Ils se caractérisent par des indices comme l'indice de saponification, l'indice d'acidité et l'indice d'ester.
|
French
|
English
|
Arabic |
| Lipides, Acides gras | Lipids, Fatty acids | دهنيات، أحماض دهنية |
PASSER UN CONTROLE SUR LES LIPIDES (THEORIE + PRATIQUE)

Lipides, Exercice 1 (Réponse 1).Indice d'acidité et détermination de la masse molaire des acides gras.
a) Qu'est ce qu'un indice d'acidité (IA) d'un lipide ?
b)Etablir la relation entre l'indice d'acidité et la masse molaire moléculaire d'un acide gras saturé. Trouver la relation entre l'indice d'acidité et le nombre d'atomes de carbone d'un acide gras saturé.
c) Calculer les indices d'acidité de l'acide butyrique et l'acide palmitique.
Données: Masse molaire de KOH (MKOH) = 56 g/mol.
Triglycérides, Exercice 2 (Réponse 2). Indice de saponification et indice d'iode
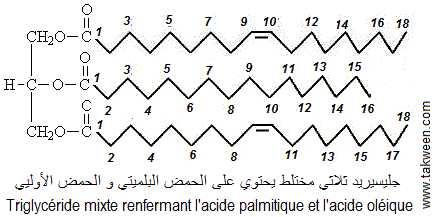
L'indice de saponification (IS) d'un triglycéride (triacylglycérol exempt d'acides gras libres) a été évalué à 196 et son indice d'iode à 59. L'analyse par chromatographie des acides gras de ce triglycéride montre qu'il est constitué d'acide palmitique et d'acide oléique. Déterminer la masse molaire de ce triglycéride et définir sa structure
Données: Masse molaire de KOH (MKOH) = 56 g/mol, la masse molaire moléculaire du diiode (MI2) est 254 g/mol.
Acides gras, Exercice 3 (Réponse 3). Indice d'iode et nombre de liaisons doubles des acides gras
Soit un acide gras linéaire possédant n atomes de carbone et dont l'indice d'iode est Ii. Etablire la relation entre l'indice Ii et le nombre d'atomes de carbone (n) et le nombre de liaisons doubles (d) de l'acide gras.
Lipides, Exercice 4 (Réponse 4). Soit un lipide présentant les détails tructuraux suivants:
- Le carbone alpha (carbone 1) du glycérol est estérifié avec l'acide stéarique.
- Le carbone béta (carbone 2) du glycérol est estérifié avec un acide gras insaturé à 18 carbone présentant deux insturations dans sa chaîne carbonnée au niveau des carnones 9 et 12 (delta 9,12).
- Le carbone 3 du glycérol est estérifié avec une molécule d'acide phosphorique (H3PO4), laquelle est liée à une molécule d'éthanolamine
(HO-(CH2)2-NH3+.
a) Ecrire la formule développée de ce lipide et préciser la nature des liaisons formées.
b) Quelle est le nom chimique de ce lipide ?
c) Calculer l'indice d'iode de ce lipide.
d) Calculer l'indice de saponification du lipide.
Lipides, Exercice 5 (Réponse 5). Qu'est ce qu'un indice d'ester (IE) d'un lipide?
Lipides, Exercice 8 (Réponse 8). Lequel de ces acides gras montre l'indice d'iode le plus grand ?

Réponse 1 (Exercice 1)
a) L'indice d'acidité (IA) d'un lipide est la masse en mg de KOH(Hydroxyde de potassium) nécessaire pour neutraliser les acides gras libres contenus dans 1 g de lipide à température ambiante.
IA n'a pas d'unité. L'indice d'acidité est aussi appelé 'indice d'acide' ou 'acidité résiduelle'.
b) Relation entre l'indice d'acidité (IA) et la masse molaire moléculaire
d'un lipide saturé et relation entre IA et le nombre d'atomes de
carbone d'un acide gras saturé.
- Relation entre l'indice d'acidité (IA) et la masse molaire moléculaire
d'un lipide saturé (MAG):
R-COOH + KOH alcoolique -----> R-COO-K+ + H2O
IA = mKOH/mAG = (nKOH * MKOH * 10 3)/nAG * MAG, avec mKOH en mg et mAG en g.
La salification d'une mole d'acide gras nécessite une mole de KOH.
Ainsi, nKOH/nAG = 1/1 = 1, d'où:
IA = MKOH * 10 3/MAG donnant MAG =
MKOH * 10 3/IA
Rappel: L'indice d'ester (IE), est la quantité de potasse, exprimée en mg, nécessaire pour saponifier 1 g de matière grasse
en considérant que l'acidité résiduelle (IA) a été éliminée. IE = IS - IA. L'indice de saponification (IS) correspond à la quantité de potasse, exprimée en mg, nécessaire pour saponifier (à chaud) 1 g de matière grasse composées d'esters d'acides gras.
- Relation entre l'indice d'acidité (IA) et le nombre d'atomes de carbone (n) d'un acide gras saturé:
La formule brute d'un acide gras saturé est CnH2nO2. La masse molaire
moléculaire de l'acide gras s'écrit:
MAG = 12 * n + 1 * 2 * n + 16 * 2 soit MAG = 14n + 32,
IA = (MKOH * 10 3)/(14n + 32) d'où:
n = (MKOH * 10 3 - 32 IA)/(14 * IA)
Calcul de l'indice d'acidité de l'acide butyrique et l'indice d'acidité de l'acide palmitique
L'acide butyrique est connu par n = 4. IA = 638
L'acide palmitique est connu par n = 16. IA = 219
D'où la conclusion: l'indice d'acidité est inversement proportinnel au nombre d'atome de carbone de l'acide gras.
Réponse 2 (Exercice 2)
Le triacylglycérol est sans acides gras libres. Donc, son indice d'ester est égal à son indice de saponification (IE = IS = 196).
Pour rappel, l'indice d'ester d'un lipide est la masse de potasse (KOH) (en mg) nécessaire pour saponifier les acides gras estérifiés contenus dans 1 g de corps gras.
Pour rappel, l'indice d'ester (IE) est égal à l'indice de saponification pour les glycérides purs. Il permet de trouver la masse molaire (donc structure) des glycérides. L'indice d'ester n'est pas mesuré. Il est calculé comme étant l'indice de saponification (IS) moins indice d'acide (IA) (IE = IS - IA).
- Masse du triacylglycérol (MTG). MTG = (3 MKOH * 10 3)/IE, soit:
MTG = (3 * 56 * 10 3)/196 = 858 g/mol.
La connaissance de l'indice d'iode et de la masse molaire permet de calculer le nombre de liaisons doubles.
R-(CH=CH)p-R' + p I2 ---- R-(CHI=CHI)p-R'
D'après la définition de l'indice d'iode (Ii),
Ii = (mI2 * 100)/mTG = (nI2 * MI2 * 100)/(nTG * MTG)
L'addition de I2 sur p doubles liaisons du TG nécessite p moles de diiode. Ainsi, nI2/nTG = p/1 = p, d'où Ii = (p * MI2 * 100)/(MTG)
et p = Ii * MTG/MI2 * 100
soit p = 59 * 858/254 * 100 = 1,99, proche de 2. Donc ce Ttriacylglycérol
contient 2 liaisons doubles.
Comme la chromatographie des acides gras constituant le TG montre que ce dernier
contient l'acide palmitique et l'acide oléique et que le nombre
de liaisons double est 2, ce TG est composé d'un acide palmitique
(sans liaisons doubles, car acide gras saturé) et de deux acides
oléiques (portant chacun une liaison double). La position respecyve
des acides gras sur le glycérol reste inconnue.
Par définition, l'indice d'iode (Ii) d'un lipide est la masse de diiode (I2), exprimée en g, capable de se fixer sur les insaturations (double liaison le plus souvent) des acides gras de 100 g de matière
grasse. De fait, l'indice d'iode d'un acide gras saturé est nul. Si on connaît la masse molaire d'un acide gras (par détermination de son indice d'acide) et son indice d'iode, on pourra déterminer le nombre de doubles liaisons de l'acide gras.
Soit d le nombre de liaisons doubles d'un acide gras et MAG sa masse. La fixation de l'iode se fait selon:
1 CH3 - - - (CH2=CH2)d- - - COOH + d I2 ----
Au total, un acide gras à d liaisons doubles consomme d * 254 g d'iode
d * MI2 g se fixe sur ------ MAG g
Ii ----> 100 g de corps gras
donc Ii = (d * MI2 * 100)/MAG ce qui entraine d = (Ii * MAG)/(MI2 * 100)
La formule d'un acide gras insaturé est CnH2n
- 2d O2.
On remplace dans l'équation MAG par: 12n + (2n-2d) + 32 = 14n -
2d + 32
d = [Ii * (14n + 32)]/[MI2 * 100 +2Ii]
Si MAG = 284 g/mol, n = 18 et Ii = 180, d sera 2 liaisons doubles. Ceci pourrait
correspondre à l'acide linoléique. Pour confirmer cela,
il faut connaître les positions de liaisons doubles.
Question sémilaire dans un contrôle sur l'indice d'iode des lipides
a) Formule développée du lipide et nature des liaisons formées.

Rappel: une phosphatidyléthanolamine, appelée céphaline pour sa présence dans la substance blanche du cerveau, est un phosphoglycéride constitutif des membranes biologiques, au même titre que les phosphatidylcholines (lécithines). Les phosphatidyléthanolamines sont
formées d'un résidu de glycérol estérifié
par deux acides gras (AG1 et AG2) et un résidu de phosphoéthanolamine.
La céphaline a été étudiée dans le
traitement des troubles de la mémoire liés au vieillissement.
Comme elle est extraite de cerveaux de bovins, l'intérêt
envers ces études s'est arrêté suite à l'épidémie
d'encéphalopathie spongiforme ('maladie de la vache folle').
En 2012, une décision des autorités de santé européennes
a jugé sans apport l'utilisation de la céphaline comme traitement
pour améliorer l'état de santé des adultes comme
des jeunes.
b)Nom chimique du lipide.
1-stéaryl,2-linoléate phosphatidyléthanolamine ou céphaline.
c) Calcul de l'ndice d'iode.
L'indice d'iode d'un lipide est le nombre de gramme d'I2 fixé par 100 g de lipide.
Détermination
de la masse molaire de ce lipide (MmL): MmL = Mm du Glycérol +
Mm de l'acide stéarique + Mm de l'acide linoléique + Mm du phosphate + Mm de l'éthanomamine - 4x Mm de H2O, équivaut
à:
MmL = 92 + 284 + 280 + 98 + 63 – 72 = 745 g.
Le lipide présente deux insaturations d'où 1 mole de
lipide fixe 2 moles d'iode donc 745 g de lipide fixe 127 x 4 = 508
g d'iode. 100 g de lipide Fixera donc : Ii = 100 x 508/745 = 68,2.
d)
Calculer de l'indice de saponification.
.
Par définition, l'Indice de saponification d'un lipide est le nombre
de mg de potasse (KOH) nécessaire pour saponifier 1 g de lipide.
1 mole de lipide est saponifiée par 2 moles de KOH.
745 g de lipide ---- 2 moles de KOH (2 x 56 g = 112 g = 112 * 103 mg).
1
g ----- Is
d'où, Is = 1x 112 * 103/745 = 150,3
Réponse 5 (Exercice 5)
L'indice d'ester (IE) est la quantité en milligrammes de KOH nécessaire
à la saponification des glycérides présents dans 1 gramme de matière grasse. IE n'est pas mesurable. Il est calculé à partir des deux indices IS (indice de saponification) et IA (indice d'acidité). C'est la différence entre l'indice de saponification et l'indice d'acidité (IE = IS - IA).
Réponse 6 (Exercice 6). L'indice d'acidité (IA) représente le nombre de mg de KOH nécessaire pour neutraliser 1g de lipides. Il renseigne sur les acides gras libres (notamment à courtes chaînes) et le degré de lipolyse (Les chaînes longues sont résistantes à la lyse). Celle-ci est favorisée par la lipase, l'humidité et la température. Pour éviter ces altérations, on pratique un raffinage, élimination de l'eau et une conservation à 4°C. Plus IA est faible, meilleure est la qualité de l'huile. Dès que IA dépasse 2%, l'huile prend un goût de savon..
Quel est l'effet du raffinage sur l'indice de saponification?
Le raffinage fait diminuer la part du saponifiable (exemple élimination des phospholipides dans le dégommage). IS diminue. Ainsi, si IS pour une huile vierge (brute) est compris entre 200 et 215, il sera compris entre 160 et 194 pour l'huile raffinée. La part des insaponifiables est impliquée dans ces variations.
 |
 |
 |
 |
Réponse 7 (suite) (Exercice 7)
Détermination de l'indice de saponification et de l'indice d'acidité
Réaction de saponification: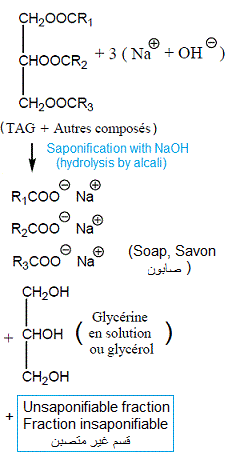
- Le dosage direct des acides gras libres peut se faire directement
(KOH dan la burette, l'huile solubilisée dans l'alcool plus l'indicateur
(phénolphtaléïne) dans le becher). KOH versée
va neutraliser directement les acides gras libres.
La quantité de KOH contenue dans le volume versé donne directement l'indice d'acidité. Cette méthode est précise. Néanmoins, elle consomme trop d'alcool.
- Le dosage en retour (méthode indirecte réalisé en TP): L'acide (HCl ou H2SO4 de normalité Na) mis dans la burette.
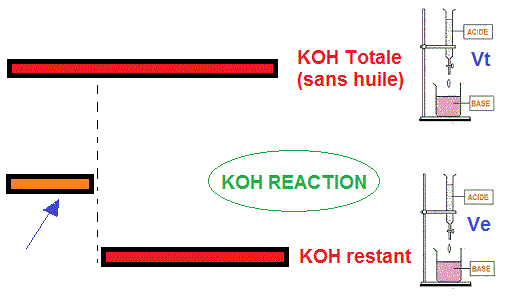
Dans l'Erlenmeyer, on met l'huile (masse m) et de la potasse alcoolique, KOH, en excès (normalité Nb). On ajoute quelqueq gouttes de l'indicateur.
Une certaine quantité de KOH va réagir avec les acides gras libres. L'excédent de KOH va être dosé par un volume Ve d'HCl. Il est nécessaire dans le dosage en retour d'effectuer un dosage supplémentaire (le témoin). Le volume de KOH additionnée à l'huile est dosé séparément par un volume Vt d'HCl
Vt neutralise la quantité totale de KOH utilisé
Ve neutralise la quantité de KOH excédentaire qui n'a pas réagi avec les acides gras
Vt - Ve est le volume de HCl nécessaire pour neutraliser
la quantité de KOH qui a réagi avec les acides gras libres.
(Vt - Ve) en ml est égale à (Vt - Ve) 10-3 litre
(Vt - Ve) 10^-3 x Na = nombre de moles d'HCl = nombre de moles de KOH qui ont réagi avec les acides gras.
Comme 1 mole de KOH ---- pèse --- 56 x 10^3
mg
(Vt - Ve) 10^-3 x Na moles KOH --- pèse ---- x' mg
cela entraîne: x' = (Vt - Ve) 10^-3 x Na x 56 x 10^3
mg de KOH.
x' neutralise les acides gras ---- contenus dans --- une masse m (en g) d'huile
IA neutralise les acides gras --- contenus dans --- 1 g d'huile (définition)
D'où:
IA = ((Vt - Ve) x Na x 56 )/m, de même IS = ((Vt - Ve) x Na x 56 )/m
Calcul du poids moléculaire (PM TG)

1
g de TG ---- consomme ------- IS mg KOH
PM TG ------- consomme ------ 3 x 56 x 10^3 mg de KOH
Ceci entraîne: PM
TG = (3 x 56 x 10^3)/IS
Exemple
d'application relatif à la relation poids moléculaire d'un
lipide et l'indice de saponification
- Dosage en retour dans la détermination des indices IS et IA (Fr):
- Triglycérides, Phospholipides et Stéroïdes (narration en Arabe, sous-titrage en Fr):
- Lipides à base d'acides gras
- QCMs, Exercices, Contrôles et Examens
- Techniques et TP
- Visualisation 3D de structures lipidiques
- Applications biotechnologiques sur les lipides et acides gras
- Olestra. Lipide synthétique
- Métabolisme des lipides
- Saponification des triglycérides (Exercices)
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
