Les travaux pratiques de Biologie moléculaire du semestre S5 (TP S5) couvrent l'extraction de l'ADN (DNA) de plantes, son hydrolyse par des enzymes de restriction comme Hind III et sa séparation par électrophorèse sur gel d'agarose. Ce TP permet de se familiariser avec les techniques de séparation en Biochimie et l'électrophorèse, en particulier.
La purification de l'ADN d'une plante a été réalisée selon le protocole utilisant le CTAB (bromure d'hexadécyltriméthylammonium) inclus dans un tampon de lyse chimique à pH basique. Après séparation par affinité aux phases suivie d'une précipitation et d'un lavage, l'ADN a été repris dans 75 µL d'eau. Un volume de 5 µL de la solution d'ADN à été soumis à l'action de l'enzyme de restriction Hind III. En présence d'un plasmide natif, de marqueurs de poids moléculaire et du même plasmide (quantité de 90 ng) hydrolysé par Hind III, l'ADN purifié a été analysé par électrophorèse sur un gel d'agarose 0,8%. Trois puits ont été aménagés sur ce gel servant de support de migration de l'ADN.
-
puits N°1 : marqueurs de poids moléculaires (250 à 10000
pb)
- puits N°2 : Extrait d'ADN purifié à partir du matériel
végétal
- puits N°3 : plasmide natif (90 ng) hydrolysé par Hind III
Les résultats obtenus, correspondant à des bandes révélées sur le gel d'agarose, sont consignés dans les 3 tableaux suivants :

Questions
1/
Citer les conditions du protocole de purification qui permettent d'avoir un ADN hautement purifié. Quel est le moyen utilisé pour vérifier la pureté de l'ADN ?.
2/ Quels sont les paramètres essentiels qui permettent de choisir la concentration convenable du gel d'agarose devant être utilisé en électrophorèse?. Justifier le choix du gel d'agarose 0,8%.
3/Quels indicateurs colorés doit-on utiliser en électrophorèse pour suivre la migration sur gel d'agarose des fragments d'ADN de taille 50 pb et 500 pb.
4/ Comment révèle-t-on tous les fragments d'ADN préalablement séparés sur gel d'agarose ?. Comment révèle-t-on un ADN porteur d'une séquence nucléotidique précise.
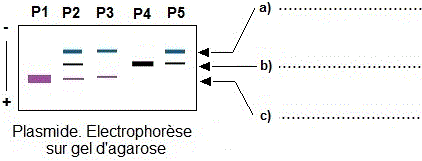
5/ L'électrophorèse du plasmide natif ayant subi des degrés de dégradation variables (P1, P2, P3, P4, P5) a permis d'obtenir les profils électrophorétiques représentés
par la figure suivante. Annoter l'électrophorégramme et classer les 5 profils selon un ordre croissant de la dégradation du plasmide.
6) A l'aide du profil éléctrophorétique du puits 1, tracez la courbe étalon log PM = f(distance).
7) Estimer les tailles en pb des zones E1 et E2 révélées
par le bromure d'éthidium après séparation sur gel
d'agarose de l'extrait d'ADN du matériel végétal
? A quoi correspondent-elles ?
8) Calculer la taille de l'ADN correspondant aux bandes révélées
par électrophorèse De l'ADN du plasmide hydrolysé.
9) Calculer la taille en pb de l'ADN du plasmide.
10) Déterminer les quantités en ng de DNA correspondants aux
3 fragments de restriction obtenus concernant le profil éléctrophorétique
du puits N°3 (plasmide hydrolysé). Préciser le nombre
de sites de restriction Hind III portés par cet ADN.
1) Citer les conditions du protocole de purification qui permettent d'avoir un ADN hautement purifié. Quel est le moyen utilisé pour vérifier la pureté de l'ADN ?.
Conditions du protocole pour un ADN hautement purifié :
- Très peu de protéines : déprotéiniser au maximum et/ou ajouter une étape de traitement avec la protéinase
K.
- Très peu d'ARN : introduire dans le protocole une étape de traitement avec la RNase.
- ADN non altéré : Favoriser les conditions d'inactivation des DNases comme :
---- utilisation d'EDTA chélatant
les Mg++, nécessaires pour les DNases
---- utilsation pH élevés lors de la purification de l'ADN.
Vérification de la pureté de l'ADN:
- par le rapport DO à 260 sur DO à 280 nm qui doit être compris entre 1,8 et 2,0. Un rapport inférieur à 1,7 renseigne sur une contamination par les protéines. Un rapport supérieur à 2,0 indique une contamination par l'ARN.
- L'électrophorèse sur gel d'agarose pouvant montrer la copurification de l'ARN (taille faible d'environ 250 pb) avec l'ADN (taille relativement élevée), renseigne sur un ADN non suffisamment purifié.
 |
 |
 |
 |
 |
2) Quels sont les paramètres essentiels qui permettent de choisir la concentration convenable du gel d'agarose devant être utilisé en électrophorèse?. Justifier le choix du gel d'agarose 0,8%.
-
Paramètres essentiels du choix de la concentration du gel d'agarose: Taille des de l'ADN et des fragments à séparer. Sachant que le gel d'agarose supporte des concentrations comprises entre 0,3% à 2%, en général,
les gels à concentrations d'agarose faibles sont choisis pour les fragments d'ADN de taille élevée. Les ADN de tailles petites
sont mieux séparés sur des gels relativement plus concentrés.
Seul le gel de polyacrylamide est conseillé pour les fragments d'ADN de taille très faible.
- Les gels d'agarose de concentration 0,8% séparent mieux les ADN de taille moyenne (10000 pb à 250 pb).
3)
Quels indicateurs colorés doit-on utiliser en électrophorèse
pour suivre la migration sur gel d'agarose des fragments d'ADN de taille 50 pb et 500 pb.
Pour suivre la migration par électrophorèse
sur gel d'agarose des fragments d'ADN de tailles 50 pb et 500 pb, il est préférable d'utiliser l'orange
blue qui migre avec les fragments d'ADN de 50 pb et le bleu de bromophénol
qui migre avec les fragments de 500 pb.
4) Comment révèle-t-on tous les fragments d'ADN préalablement séparés sur gel d'agarose? Comment révèle-t-on un ADN porteur d'une séquence nucléotidique précise.
-
Révélation de tous les fragments : utilisation du bromure d'éthidium.
- Révélation de séquences nucléotidiques précises
: usage d'une sonde
marquée qui s'hybride avec la séquence d'ADN. Pour réaliser
cette étape, il faut faire le transfert (southern blotting).
Biologie moléculaire, Examen. Réponses (suite)
5) L'électrophorèse du plasmide natif ayant subi des degrés de dégradation variables (P1, P2, P3, P4, P5) a permis d'obtenir les profils électrophorétiques représentés par la figure suivante. Annoter l'électrophorégramme et classer les 5 profils selon un ordre croissant de la dégradation du plasmide.
a)
Plasmide. Forme relachée, b) Plasmide. Forme linéaire, c)
Plasmide. Forme superenroulée.
Ordre croissant de la dégradation du plasmide : P1<P3<P2<P5<P4
La forme intact : forme superenroulée. Hydrolyse sur un seul brin du plasmide superenroulé génère la forme relachée. L'hydrolyse sur les deux brins génère la forme linéaire.
6) A l'aide du profil éléctrophorétique du puits 1, tracez la courbe étalon log PM = f (distance).

7) Estimer les tailles en pb des zones E1 et E2 révélées par le bromure d'éthidium après séparation sur gel d'agarose de l'extrait d'ADN du matériel végétal ? A quoi correspondent-elles ?
-
E1 : 9000 pb : ADN
- E2 : 300 - 500 pb : ARN
(Voir
tache d'ARN de taille moyenne 250
pb obtenue après électrophorèse sur gel d'agarose d'un ADN purifié et soumis à l'action de Hind III en absence de la RNase)
8)
Calculer la taille de l'ADN correspondant aux bandes révélées
par électrophorèse De l'ADN du plasmide hydrolysé.
H1 : 3000 pb, H2 : 2000 pb et H3 : 1000 pb
9) Calculer la taille en pb de l'ADN du plasmide.
Taille du plasmide : H1 + H2 + H3 = 6000 pb
10)
Déterminer les quantités en ng de DNA correspondants aux
3 fragments de restriction obtenus concernant le profil éléctrophorétique
du puits N°3 (plasmide hydrolysé). Préciser le nombre
de sites de restriction Hind III portés par cet ADN.
-
H1 représente 6000/3000 = ½ de la taille totale du plasmide,
soit 90/2 = 45 ng.
-
H2 représente 6000/2000 = 1/3 de la taille totale du plasmide,
soit 90/3 = 30 ng.
-
H3 représente 6000/1000 = 1/6 de la taille totale du plasmide,
soit 90/6 = 15 ng
Le
nombre de sites de restriction Hind III portés par cet ADN est
3.
- Biologie moléculaire. Examen Travaux pratique, Archives
- Biologie moléculaire. Examen écrit S4 (2011)
- Electrophorèse. QCM
- Acides nucléiques. Contrôle écrit S4
- Extraction, purification et électrophorèse de d'ADN de plantes. TP S4
- DNA electrophoresis on agarose gel
- Protocole de purification de l'ADN. TP S4
- QCM purification ADN des plantes (TP S4)
- Purification, analyse DNA du plasmide. Contrôle TP 2015
- Biologie moléculaire. Examen TP S5 2016
- Biologie Moléculaire. Examen (Contrôle) TP 2018-19
- Biologie Moléculaire. Examen (Contrôle) TP 2022-23
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
