Le critère de l'ionicité des molécules donne lieu aux techniques de chromatographie échange ions (ion exchange chromatography, كروماتوغرافيا التبادل الإيوني
La chromatographie d'échange d'ions sépare les protéines en fonction de leur charge de surface nette, grâce à des interactions électrostatiques qui se produisent entre les protéines et une phase stationnaire chargée.
Deux types de chromatographie d'échange d'ions sont à distinguer:
- Chromatographie d'échange d'anions (phase stationnaire chargée positivement qui se lie à des protéines chargées négativement).
- Chromatographie d'échange de cations (phase stationnaire chargée négativement qui se lie à des protéines chargées positivement).

La
chromatographie d'échange d'ions est souvent utilisée comme une étape intermédiaire dans un protocole
de purification des protéines. Cependant, elle peut donner une résolution élevée pour certaines
protéines lorsqu'elle est utilisée plus tôt ou plus tard au cours de la purification.
Tout dépend du pH du tampon et du pI des molécules à séparer!
L'échange ionique est en rapport avec la charge électrique nette des protéines et qui dépend de leurs compositions en acides aminés. La charge nette d'une protéine est influencée
par le pH du solvant (tampon) dans lequel elle est dissoute (échange des ions d'hydrogène avec les protéines).
Le point isoélectrique (pI) d'une protéine est
le pH auquel la protéine a une charge globale nette égale
à zéro. A un pH supérieur au pI, une protéine aura une charge nette négative. Un pH inférieur au pI rend la
protéines chargée positivent (assez de H+). Ainsi, le pH du solvant peut être ajusté afin de faciliter la liaison des prorotéines aux résines échangeuses d'ions
ou de promouvoir leur élution une fois liées.
La connaissance préalable du point isoélectrique d'une protéine peut aider à déterminer le type de chromatographie échangeuse d'ions le plus approprié. Le calcul du pI théorique d'une protéines est basé entièrement
sur sa séquence d'acides aminés. Il ne prend pas en compte la structure tridimensionnelle de la protéine. Dans son état naturel, certains résidus d'acides aminés
d'une protéine sont plus exposés que d'autres. Il en résulte une différence entre le pI calculé théoriquement et le pI réel et la charge électrique réelle de surface de la protéine. De même, la distribution des acides aminés les uns par rapport aux autres peut affecter
le pI d'une protéine (ceci n'est pas pris en considération lors des calculs théoriques de pI). Certaines techniques comme l'isoélectrofocalisation permettent la détermination expérimentale du pI d'une protéine à l'état
natif.
En règle générale, Un pH de tampon (solvant) qui est d'environ à une unité de pH loin du pI est suffisant pour la liaison d'une protéine en chromatographie d'échange d'ions. Cependant, dans certains cas, un pH du tampon plus éloigné du pI devient nécessaire.
Quatre groupes fonctionnels chargés sont plus couramment utilisés dans la chromatographie d'échange d'ions. Ils sont classés en 'échangeurs d'anions' er 'échangeurs de cations'.
Echangeurs d'anions (phase stationnaire chargée positivement)
Exemples:
- Ammonium quaternaire (Q) - échangeur d'anions fort
- Diéthylaminoéthyle (DEAE) - échangeur d'anions faible
La chromatographie d'échange d'anions DEAE-cellulose ne doit pas être utilisée à des pH supérieurs à pH 8,5. Le groupe diéthylamino (-CH2-CH2-NH+-CH2-CH3) du DEAE-cellulose
porte une charge positive qui est à la base du fonctionnement de cette colonne. En effet, les acides aminés/protéines chargées négativement vont se lier (via des liaisons électrostatiques) au groupe diéthylamino (molécules retenues), alors que les acides aminés/protéines
chargés positivement se retrouveront dans l'éluant (molécules non retenues).Comme le groupe diéthylamino possède un pKa voisin de 8,5, ce groupe sera déprotoné à un pH supérieur à 8,5, ce qui lui enlève toute sa capacité à lier des substances chargées
négativement..
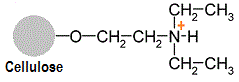
Echangeurs de cations (phase stationnaire chargée négativement)
Exemples:
- Méthyl sulfonate de (S) - échangeur de cations fort
- Carboxyméthyl (CM), - échangeur de cations faible
Les
échangeurs faibles (fournissant moins de rétention pour
certaines protéines, ce qui permet leur élution à
une force ionique plus faible) sont plus appropriés pour des
protéines qui ne nécessitent pas un pH extrême
pour la liaison et ainsi on peut éviter l'impact d'une force
ionique élevée sur la stabilité des protéines,
lors de l'élution.
Dans
la chromatographie d'échange d'ions, la phase stationnaire
(colonne) est d'abord équilibrée avec un tampon à
force ionique faible. L'échantillon de protéines est
ensuite chargé sur la colonne dans le même tampon de
faible force ionique utilisé pour l'équilibrage
de la colonne. La protéine liée est lavée abondamment
(lavage) avant l'élution avec un tampon de force
ionique plus élevée ou, dans certains cas, un tampon
avec un pH modifié. Néanmoins, on peut peut ajuster
le pH du tampon de façon à ce que la protéine
d'intérêt ne se lie pas à l'échangeur d'ions
tandis que les protéines contaminantes le font. Dans
ce cas, la protéine d'intérêt n'est pas retenue
(elle est recueillie dans la phase d'écoulement de la colonne),
alors que les protéines contaminantes, retenues sur la colonne,
sont éliminées.
 |
 |
 |
 |
 |
Elution avec les sels: En général, les sels tels que NaCl ou KCl sont utilisés pour l'élution. Les ions Na+ ou K+ servent de contre-cations dans la chromatographie d'échange de cations et Cl - servent de contre-anion dans la chromatographie d'échange d'anions.
Il
existe trois méthodes générales d'élution
des protéines: élution en une seule étape, élution
par plusieurs étapes, et élution par un gradient de
concentration linéaire. La meilleure méthode à
choisir dépend du type de chromatographie utilisé et
de la résolution requise.
- Par une seule étape - une seule étape d'élution
(par exemple, utilisation d'une seule concentration en sel)
déplace toutes les protéines liées. Ce
mécanisme fonctionne le mieux pour les procédures
chromatographiques basées sur une interaction très
spécifique (par exemple, la chromatographie d'affinité).
L'élution en une étape n'offre pas de résolution,
mais reste idéale pour se débarrasser des contaminants
très rapidement. Elle nécessite la connaissance
préalable des conditions de tampon nécessaires
pour le déplacement de la protéine d'intérêt.
- Par plusieurs étapes - plusieurs élutions
sont effectuées séquentiellement (par exemple,
utilisation de concentrations différentes en sel), avec
des conditions plus strictes à chaque étape. Dans
une élution par étape, le nombre de fractions
recueillies est fonction du nombre de conditions d'élution
séquentielles. L'élution par étapes fournit
une meilleure résolution que l'élution en une
seule étape, mais une résolution plus faible que
le gradient d'élution linéaire.
- Par un gradient de concentration linéaire -
plusieurs fractions consécutives sont rassemblées
tandis que les conditions d'élution sont ajustées
de façon linéaire.
Exemple de protocole de purification des peroxydases du broccoli (Brassica oleracea)

Un
gradient linéaire (par exemple, un gradient de concentration
en sel) offre la plus haute résolution pour la chromatographie
échangeuse d'ions et la chromatographie d'interaction hydrophobe.
En règle générale, un grand nombre de fractions
consécutives sont collectées.
Elution avec le pH: Pour les protéines liées à
un échangeur de cations (exemple CM-cellulose, chargée
-), l'augmentation du pH du tampon conduit à une charge positive
moindre sur la protéine (tendance à charger la protéine
-), et permet son élution de la colonne. Pour les protéines
liées à un échangeur d'anions (exemple DEAE-cellulose,
chargée +), la diminution du pH du tampon entraine une charge
négative moindre sur la protéine (tendance à
charger la protéine +), et permet son élution de
la colonne.
| Problème | Cause | Solutions |
| la protéine n'est pas éluée | La force ionique du tampon d'élution est trop faible | Augmenter la force ionique |
| la protéine est agrégée sur la colonne | Ajuster les conditions du tampon pour une meilleure stabilité de la protéine | |
| La protéine ne se lie pas | colonne pas équilibrée | Faire passer plus de tampon d'équilibration sur la colonne et recharger la protéine sur la colonne |
| La force ionique du tampon de liaison est trop élevée | Diminuer la force ionique du tampon | |
| pH n'est pas assez éloigné du pI | Ajuster le pH du tampon (diminuer pour l'échange de cation et augmenter pour l'échange d'anion) | |
| Résolution faible | La colonne n'a pas été lavée suffisamment | Laver la colonne avec un tampon de force ionique plus élevée, nettoyer la phase stationnaire en suivant les recommandations du fournisseur |
| le débit est soit trop rapide soit trop lent | Ajuster le débit | |
| La protéine est agrégée sur la colonne | Ajuster les conditions du tampon pour une meilleure stabilité de la protéine | |
| La protéine a perdu son activité durant la procédure | un cofacteur nécessaire à l'activité a été éliminé pendant la purification | Ajouter un cofacteur |
| La protéine est dénaturée ou agrégée sur la colonne | Ajuster les conditions du tampon pour une meilleure stabilité de la protéine |
Complément d'information: Protein-Purification
- Chromatographie sur papier
- Chromato sur couche mince (CCM)
- Polarité
- Taille
- (Chromato d'exclusion, gel
exclusion chromatography, كروماتوغرافيا الإقصاء، كروماتوغرافيا التغلغل
- Chromatographie d'affinité (Affinity chromatography, كروماتوغرافيا الألفة)
- Chromato d'interactions hydrophobes (hydrophobic interaction chromatography, كروماتوغرافياالتفاعل الهيدروفوبي)
- Séparation des protéines (chromatographie, ..). Exercices
- Chromatographie, Electrophorèse. QCM
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
