Takween. Sciences de la vie, Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
Takween. Sciences de la vie, Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
Quick search within this site and related author sites (Fr, Ar, Eng)
بحث سريع في هذا الموقع و المواقع المرتبطة للمؤلف
Recherche rapide dans ce site et les sites liés de l'auteur (Fr, Ar, Eng)
L'hémoglobine est une protéine du sang (portée par les glubules rouges). Cette protéine fixatrice d'oxygène présente un poids moléculaire de 68 Kd en solution neutre. Hémoglobine. Structure Rastop 1, Hémoglobine 2, Hémoglobine 3 et Hémoglobine 4.
Sur cette même page:
- Hémoglobine. Structure 3D
- Le changement de pH déclenche les échanges
gazeux O2 - CO2 au niveau de l'hémoglobine.
L'intérêt de l'étude de l'hémoglobine vient du fait qu'elle constitue le meilleur exemple pour étudier la relation structure-fonction des protéine démontrée par les mutations. La composition anormale de l'hémoglobine (Hbs) entraîne une maladie métabolique caractérisée par une anémie avec des globules rouges apparaissant en forme de croissant ou de faucille (falciforme). L'hémoglobine sanguine normale est représentée par 'HbA'. L'étude biochimique montre que la molécule d'hémoglobine normale (HbA) ne diffère pas de son homologue altérée (Hbs), sauf au niveau de l'acide aminé numéro 6, c'est-à-dire l'acide glutamique, qui a été remplacé par un autre acide aminé, la valine.
L'oxygène (O2) est très difficile à transporter dans les liquides biologiques. La nature a trouvé une solution à cette contrainte en terme du chargement de cet élément sur une protéine; l'hémoglobine portée par les globules rouges (hématies). Chaque globule rouge contient environ 280 millions de molécules d'hémoglobine et il y a environ 5 millions de globules rouges par mm3 de sang.
L'hémoglobine est constituée de 2 sous unités (alpha et béta) existantes chcune en deux exemplaires. C'est une structure quaternaire alpha2-béta2. Le pliage de type globine comporte 8 ségments alpha-hélicoïdaux désignés par les lettres A à H en commençant par l'extrémité N-terminale.
ينبع الاهتمام بدراسة الخضاب الدموي من كونه يشكل أحسن الأمثلة لدراسة العلاقة صفة-بروتين داخل محور الدلالة الوراثية للطفرة (Mutation) . ينتج عن التركيب الغير العادي للخضاب (Hbs) مرض استقلابي يتميز بفقر الدم مع ظهور كريات الدم الحمراء في شكل هلالي أو منجلي (Falciforme). يرمز لخضاب الدم العادي ب 'HbA'. تبين الدراسة البيوكيميائية أن جزيئة خضاب الدم العادية (HbA) لا تختلف عن نظيرتها المتغيرة (Hbs) إلا في الحمض الأميني رقم 6، أي حمض الكلوتاميك (Acide glutamique) الذي استبدل بحمض أميني آخر، هو الفالين (Valine). المزيد
من المعلومات في كتاب علوم الحياة - بيوكيمياء
يعد الهيموغلوبين بروتينا ذو بنية رباعية من نوع a2-b2 تلتقي فيها السلاسل بروابط هيدروفوبية،
عموما ، يصل وزنه 68000 و يحتوي على مجموعة ذات طابع غير بروتيني و تظم ذرة من الحديد (Fer, Fe++) . تلقب المجموعة ب: الهيم (Hème). يتموقع هذا الأخير بفجوة ذات طابع غير قطبي ويلتقي بالطرف
البروتيني من خلال رابطة بين ذرة الحديد والحمض الأميني هيستيدين رقم 92 (His92) في سلسلة
b أو هيستيدين رقم 87 (His87) في سلسلة a. يلقب
هذا الحمض الأميتي ب: 'الهيستيدين القريب (Histidine proximal). هناك هيستيدين آخر يلعب دورا هاما في
التقاط الأوكسيجين (Oxygène, O2) و يسمى ب: 'هيستيدين البعيد' (Histidine distale)، يتجلى في
His63 بسلسلة b أو His58 بسلسلة a. بواسطة رابطة هيدروجين بين هذا الهيستدين و الأوكسيجين (His-N-H….O-O) يلتقي الأكسيجين بذرة الحديد. -----البقية
في الكتاب
Dans l'hémoglobine, les contacts entre les chaînes alpha et béta sont essentiellement de type hydrophobe. Environ un tiers d'entre eux font intervenir des liaisons H et des interactions hydrostatiques entre des radicaux polaires.
L'hémoglobine contient du fer faisant partie d'une structure
appelée hème logé au sein de l'apoprotéine et entouré par plusieurs acides aminés dont deux histidines. L'oxygène moléculaire (O2) se fixe au fer en se positionnant
entre l'histidine distale et le fer (Fe++).
Avertissement: la visualisation des molecules par JMOL nécessite l'installation de java (https://www.java.com). Si problème aciver java pour votre navigateur.
Hémoglobine désoxygénée - خضاب بدون أكسيجين
|
Coloration تلوين |
Sélection إنتقاء Affichage إستظهار |
L'apoprotéine
stabilise le fer dans l'état ferreux Fe++. En absence de cette protection
Fe++ est oxydé en Fe+++ (état ferrique) par l'oxygène
(état où il ne pourra plus se lier à l'oxygène).
L'hème peut être visualisé en faisant un clic droit de la souris sur
la molécule et en choisissant: selectionner --> hetero --> ligand
et et visualiser sous 'sphères' (100%). En plus de JMOL, l'hémoglobine
peut être étudiée par Rastop.
La mutation
qui fait remplacer Glu6 en Val6 de la chaîne béta de l'hémoglobine
donne l'anémie falciforme.
Localiser l'acide aminé 6 (Glu) et préciser la chaîne
à Laquelle appartient. Ceci peut être de différentes façons.
On peut saisir un petit programme dans la console: 1/ Clic droit sur la molécule
-> Console -> écrire select Glu6,
valiser par la touche 'return' puis saisir encore color
magenta et visualiser sous 100%
Hémoglobine oxygénée - خضاب بالأكسيجين
|
Ici, sont montrées uniquement une chaîne A et une chaîne B Coloration تلوين |
Sélection إنتقاء Affichage إستظهار |
Etude des liaisons دراسة الروابط
Localiser
la position de l'oxygène (O2) par rapport à l'histidine distale
et l'histidine proximale:
1/ Selection 'tout' -> 2/ Visualiser 'batonnets' -> 3/ Clic droit de la
souris sur la molécule et choisir 'selectionner' -- Hétéro
-- Par HETATM -- HEM puis visualise l'hème sélectionné
sous 100% -> Faire zoom sur l'hème et les structures qui l'entoure
(maintenir appuyé le bouton shift de l'ordinateur tout en bougeant
la souris partie gauche maintenue appuyée)
- s'assurer de la position de l'oxygène (passer la souris sous les
éléments, leurs noms s'affichent automatiquement) -- selectionner
toutes les His en suivant clic droit 'selectionner', 'protéine', 'Par
nom de résidu' et 'HIS' et colorer ces histidines en suivant clic droit,
'couleur', 'atome' et 'cyan' et finalement noter le numéro de l'His
la plus proche de O2 (il s'agit de l'histidine distale).
L'hémoglobine
agit comme font les enzymes
allostériques (enzymes régulatrices), car possédant
une structure quaternaire (tétramère avec 2 chaînes alpha
et 2 chaînes béta)
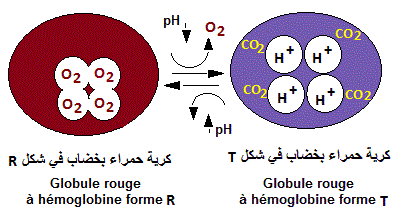
Le pH faible, résultant de l'acide carbonique généré
par le CO2 ( CO2 + H2O --> HCO3- + H+), induit une transition R -->
T, conduisant à une diminution de l'affinité de l'hémoglobine
forme R pour O2, qui sera libéré. Par contre l'affinité
pour CO2 et H+ va augmenter conduisant ainsi à leur fixation sur l'hémoglobine
forme T.
Lors d'une transition de T vers R, les sous-unités alpha1-béta1 se rapprochent des sous-unités alpha2-béta2. Il en résulte une réduct la ion de la taille de la cavité centrale entre les sous-unités.
En présence
d'oxygène (O2) et à pH élevé, le mouvement de
différentes hélices alpha de l'hémoglobine fait que l'atome
de fer se déplace par rapport au groupement hème. Cette configuration
est convenable pour la fixation de O2 sur le fer. Quand le pH baisse, la réaction
inverse se produit:
les hélices reprennent leur position typique de la forme T, la cavité
centrale grandit, et l'atome de fer est déplacé par rapport
au groupe hème. Il en résulte le départ de O2. Les ions
H+ ne se fixent sur l'histidine 146 de la béta-globine et à
deux autres résidus dans l'alpha-globine de la forme T. Quant au CO2,
il se lie à l'extrémité N-terminale de chacune
des quatre chaînes de globine formant la carbaminohémoglobine.
---> Relation structure-fonction
(Hémoglobine). Exercice- علاقة بنية-وظيفة للبروتينات
، حالة الخضاب الدموي
-
Acides aminés Par JMOL
- Peptides par JMOL
- Enzymes par JMOL
- JMOL, Rastop معاينة جميع
الجزيئات ب
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.

Chaine Youtube (abonnement).
Plusieurs vidéos multilingues
LIVRES
+ DVD
Ouvrages
(livres) multilingues pour faciliter la transition Secondaire-Supérieur
(Ar, Fr) avec DVD + QCMs, Exercices:>
-Glossaire trilingues Français-Arabe-Anglais

- Livre 'Sciences de la vie. Protéines et Enzymes' (+ DVD), Baaziz,2013


- آفاق الدراسات بكليات العلوم و رد الاعتبار لمؤسسات ا لتعليم العالي ذات الاستقطاب المفتوح
- تحميل ملفات في مواضيع البيوكيمياء Téléchargement de fichiers en Biochimie
- Congrès,Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo. annonces