
| French
|
Arabic
|
English
|
| enzymes. Enzymologie | انزيمات، إنزيمولوجيا | Enzymes, Enzymology |
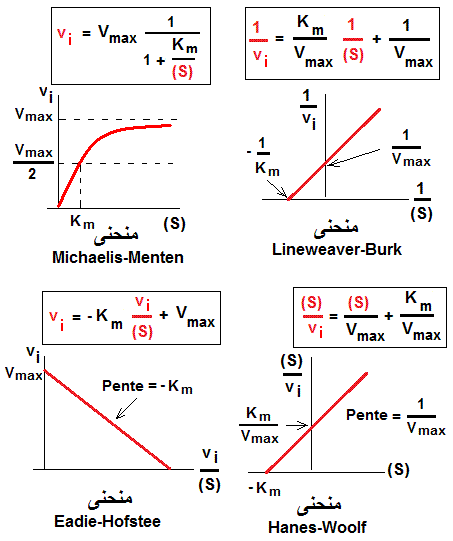
L'enzymologie (إنزيمولوجيا) du niveau S4 concerne des cas d'enzymes variées avec différentes cinétiques en présence des substrats et en absence ou en présences des inhibiteurs (compétitifs, non compétitifs, incompétitifs et mixte).
On étudie la cinétique de l'enzyme thréonine déshydratase ou L-thréonine hydro-lyase (E.C.4.2.1.16) d'E. Coli. Cette enzyme catalysant la transformation de la L-thréonine (4 carbones) en acide 2-oxobutyrique (4 carbones) + ammonic (désamination), est la première enzyme spécifique de la biosynthèse de l'isoleucine.
| Concentration en substrat (M) | Vitesse initiale (mole/min/ml d'enyme) |
| 0,00100 | 0,000125 |
| 0,00125 | 0,000150 |
| 0,00167 | 0,000177 |
| 0,00250 | 0,000228 |
| 0,00500 | 0,000315 |
L'action de deux inhibiteurs sur l'enzyme a été étudiée. Elle concerne D-allothréonine (isomère de L-thréonine) et L-isoleucine (produit final de la voie métabolique). Les vitesses initiales de l'enzyme obtenues avec L-thréonine en présence de chacun des deux inhibiteurs sont présentées dans le tableau:
| L-thréonine (M) | Vitesse initiale en preacute;sence de D-allothréonine (0,01 M) en mole/min/ml d'enzyme (10 -4) | Vitesse initiale en présence de L-isoleucine (0,001 M) en mole/min/ml d'enzyme (10 -5) |
| 0,00100 | 0,62 | 3,87 |
| 0,00125 | 0,74 | 4,54 |
| 0,00167 | 0,95 | 5,50 |
| 0,00250 | 1,30 | 7,06 |
| 0,00500 | 2,00 | 9,60 |
1/ Calculer les paramètres cinétiques Km et Vmax de l'enzyme pour son substrat utilisé en absence et en présence de chacun des deux inhibiteurs.
2/ Déterminer le type d'inhibition exercée par les deux inhibiteurs.
- En présence de la D-allothréonine comme inhibiteur:

- En présence de la Isoleucine:

2- Paramètres cinétiques Km et Vmax de l'enzyme pour son substrat utilisé en absence et en présence de chacun des deux inhibiteurs (Km' et Vmax' = constantes en présence d'un inhibiteur):
| Vmax (mole/min/ ml d'enzyme) | Km (M) | Type d'inhibition vis à vis de L-thréonine | |
| L-thréonine seule | 0,000500 | 0,00290 | - |
| En présence de D-allothréonine | 0,000500 | 0,00625 | compétitive |
| En présence de L-isoleucine | 0,000153 | 0,00290 | non compétitive |
La carboxypeptidase (E.C.3.4.17.1) est une enzyme qui catalyse l'hydrolyse de la carboxyphénylalanine comme substrat. Son étude cinétique avec le substrat seul ou en présence du phényl-butyrate ou du benzoate, donne les vitesses initiales suivantes:
| Vitesse initiale (unités) | |||
| Carboxy- phénylalanine (M) | Substrat seul | Avec Phényl-butyrate (0,002 M) | Avec benzoate (0,05 M) |
| 0,0125 | 133 | 28,5 | - |
| 0,0175 | - | - | 30,3 |
| 0,0250 | 167 | 50,00 | 33,3 |
| 0,0400 | - | 71,5 | - |
| 0,0500 | 190 | - | 38,4 |
| 0,0550 | - | 90,9 | - |
| 0,1000 | 205 | - | 40,8 |
1-
Déterminer les constantes cinétiques Km et Vmax de la carboxypeptidase en absence des inhibiteurs.
2- Calculer Km et Vmax de l'enzyme en présence des inhibiteurs.
3- Quels types d'inhibiteurs constituent le phényl-butyrate et le benzoate vis à vis du substrat, la carboxyphénylalanine.
4- Calculet les constantes Ki pour chaque inhibiteur.
Réponse
1- les constantes cinétiques Km et Vmax de la carboxypeptidase en absence des inhibiteurs: Km = 8,35 mM, Vmax = 222 unités.
2- En présence du phényl-butyrate: Km' = 98,9 mM, Vmax' = 250 unités (considérée proche de 222 unités (= Vmax))
- En présence du benzoate: Km' = 8,11 mM (considérée proche de 8,35 mM (= Km)), Vmax' = 44,3 unités
3- Types d'inhibition: Phényl-butyrate = inhibiteur compétitif vis à vis de la L-thréonine
- Bensoate = inhibiteur non compétitif vis à vis de la L-thréonine
4- Valeurs de la constante d'inhibition:
- Pour phényl-butyrate: Km a augmenté du facteur (1 + (I/Ki), donc: Km' = Km x (1 + (I/Ki)) c'est à dire: 98,9 = 8,35 (1 + (0,002/Ki)), donc: Ki = pour phényl-butyrate = 0,2 mM.
- Pour le benzoate: Vamx a diminué du facteur (1 + (I/Ki),
donc: Vmax' = Vmax / (1 + (I/Ki)) c'est à dire: 44,3 = 222 /(1 + (0,05/Ki)), donc: Ki = 12,4 mM
(adapté à partir de Lafont et al. Exercices de Biochimie)
La créatine
phosphokinase (CPK) est une enzyme présente dans les cellules musculaires.
Elle catalyse la réaction suivante:
Créatine + ATP <------> Créatine-phosphate + ADP
1- La purification de la CPK à partir du muscle squelettique de lapin a été faite selon le protocole suivant:
| Extraits | Etapes | Protéines (mg) | Activité totale (UI) |
| E1 | Broyage et homogénéisation de muscle squelettique de lapin | 40000 | 189000 |
| E2 | Surnageant de centrifugation après précipitation par NH4Cl à pH = 9,0 | 9050 | 179000 |
| E3 | Surnageant de centrifugation après précipitation par MgSO4 | 3250 | 143000 |
| E4 | Précipitation par l'éthanol à froid. Dissolution du précipité dans une solution de citrate d'ammonium | 2970 | 138000 |
| E5 | Dialyse | 2480 | 129000 |
| E6 | Cristallisation à -10°C | 2150 | 112500 |
-
Calculer le taux de purification pour les extraits E5 et E6 par rapport
à E1
- La dernière étape est-elle indispensable ?
2- Etude de la cinétique de la CPK.
On mesure la vitesse initiale (vi) de la CPK en fonction de concentrations croissantes d'ATP (= substrat S). La concentration en créatine étant constante. Les résultats sont indiqués dans le tableau suivant:
| ATP (mmol.dm -3) | vi (mole de produit apparu/seconde) |
| 0,20 | 1,36 |
| 0,27 | 1,70 |
| 0,41 | 2,22 |
| 0,79 | 3,12 |
- Déterminer les paramètres cinétiques Km et Vmax de la CPK pour l'ATP.
- Sachant que la constante Km de l'enzyme pour la créatine est de 0,019 mol.dm -3, comparez les affinités respective de la CPK pour les deux substrats. Les quantités d'ATP et de créatine par gramme de tissu musculaire sont 4 µmol/g et 25 µmol/g, respectivement.
 |
 |
 |
Enzyme CPK (suite)
3- Effet du Zinc sur l'activité de la CPK
La vitesse initiale de l'enzyme est mesurée en absence et en présence
de deux concentrations de Zn++ (C1 et C2). Les résultats sont indiqués
dans le tableau suivant:
| ATP (mmol. dm -3) | vi (mole de produit apparu/seconde) | |
| Zn++ = C1 mol.dm-3 | Zn++ = C2 mol.dm-3 | |
| 0,20 | 1,00 | 1,16 |
| 0,27 | 1,23 | 1,45 |
| 0,41 | 1,61 | 1,89 |
| 0,79 | 2,27 | 2,70 |
Comment se comporte le Zn++ vis avis de l'ATP ?
| Extraits | AS (U/mg) | Taux de purification | Rendement (%) |
| E1 | 4,725 | 1 fois | 100 |
| E2 | 19,78 | 4,19 fois (= 19,79/4,725) | 94,71 (= (179000/ 189000) x 100) |
| E3 | 44 | 9,31 fois | 75,66 |
| E4 | 46,46 | 9,83 fois | 73 |
| E5 | 52 | 11 fois | 68,25 |
| E6 | 52,33 | 11,07 fois | 59,52 |
Avec ce protocole de purification, la créatine phosphokinase a été purifiée 11 fois avec une perte de 31,75% (= 100 - 68,25) (étape E5). En ajoutant l'étape E6, on perd plus d'enzyme sans gain dans la purification par rapport à l'étape précédente. Donc, la dernière étape n'est pas indispensable.
2- Etude de la cinétique de la CPK.
- Paramètres cinétiques Km et Vmax de la CPK pour l'ATP (voir courbe ci dessous): Km = 0,57 mM, Vmax = 5 mol/s
- L'affinité de l'enzyme pour l'ATP est plus grande que celle pour la créatine
3- Effet de Zn++ sur l'activité de la CPK: Zn++ est inhibiteur compétitif vis à vis de l'ATP


- QCM-Enzymes. Structure et fonction (bases)
QCM Enzymes michaeliennes et enzymes allostériques
- Hexokinase
- Coenzyme
Atransférase
- Amine
oxydase
- Inhibiteurs.
Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Enzymologie. Examen-1
- Enzymologie. Examen-2
- Enzymologie. Examen-3
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase. Examen S5
- Phospholipase A2. Examen
- ADP-Glucose pyrophosphorylase et Pectine méthylestérase. Examen S5
- Enzymes, Métabolisme.
Exercices
- Enzymes. Km et Vmax. Exercices

Actions
takween pour la promotion de la culture scientifique et la réussite
de la transition Lycée-Université
تكوين. دعم الثقافة العلمية و مواكبة الانتقال
من الثانوية إلى الجامعة
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
