L'enzymologie de la shikimate déshydrogénase permet de se rendre compte de son mécanisme de catalyse.
EXAMEN DE ELEMENT DE MODULE : Enzymologie Approfondie (Cours théorique et pratique : M. BAAZIZ). MODULE 'Enzymologie Approfondie et Substances Naturelles'. MASTER : SCIENCE DE LA VIE ET DE LA SANTE. Session de Janvier 2010,Durée : 1 heure 30 min
QUESTION 1 (14 points)
...... Réponses brèves
La biosynthèse des acides aminés aromatiques implique l'enzyme shikimate déshydrogénase qui catalyse la transformation de l'acide shikimique (Shi) en acide déshydroshikimique (DShi) selon la réaction suivante :

Les cinétiques de la shikimate déshydrogénase (sens 1) sont étudiées en faisant varier, à chaque fois, l'un des substrats tout en maintenant l'autre substrat à une concentration constante. Elles sont caractérisées par des diagrammes primaires 1/v = f(1/Shi) et 1/v = f(1/(NADP+) ayant l'allure d'un faisceau de droites. Les différentes droites des 2 diagrammes primaires font intersection avec les axes des ordonnées en plusieurs points et se joignent au dessous de l'axe des abscisses.
Afin de préciser le mécanisme de catalyse de la shikimate déshydrogénase , les effets inhibiteurs des produits de la réaction ont été étudiés sur les substrats Shi et NADP+. Ainsi, le produit DShi donne vis à vis de Shi et NADP+ une inhibition caractérisée cinétiquement
par une diminution unique de la vitesse maximale de la réaction (Vmax). Par contre, le produit NADPH fait augmenter, uniquement, le paramètre Km relatif à la fixation de NADP+ sur l'enzyme. Il fait diminuer Vmax sans affecter Km dans le cas du substrat Shi.
L'utilisation d'un analogue structural du shikimate dans les tests enzymatiques
entraine une stimulation de la fixation du NADP+ sur l'enzyme.
1/ Sans considération des effets inhibiteurs exercés par les produits de la réaction, proposer les mécanismes de réaction susceptibles de rendre compte des cinétiques de la shikimate déshydrogénase. Justifier votre réponse
2/ Préciser les types d'inhibition exercées par les produits de la réaction vis à vis des différents substrats.
3/ Préciser le(s) type(s) d'inhibition exercées par l'analogue structural du shikimate vis à vis du NADP+
4/ En s'aidant des types d'inhibition par les produits de la réaction et les analogues de substrats, déterminer le mécanisme de catalyse précis de la shikimate déshydrogénase. Donner
le(s) shéma(s) de Cleland correspondant(s).
QUESTION 2 (6 points)
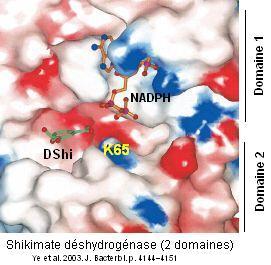
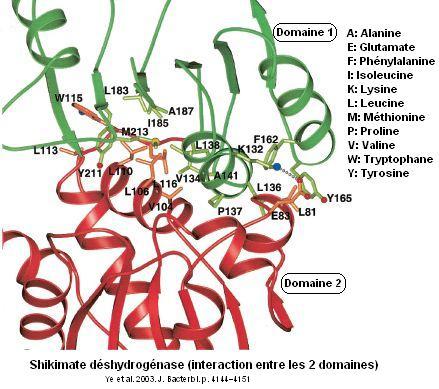
Interpréter les structures enzymatiques ci-dessous relatives à la shikimate déshydrogénase formée d'un monomère avec deux domaines.
Corrections brèves
Question 1
1/ Mécanismes: aléatoire (fixation dépendante), séquencé, Théorell-Chance.
2/ Inhibitions par les produits: Dshi/NADP+: non compétitive ou mixte, Dshi/Shi: non compétitive ou mixte, NADPH/NADP+: compétitive, NADPH/Shi: non compétitive ou mixte ou mixte. 3/ Inhibition par l'analogue de substrat: Analogue de Shi/NADP+: incompétitive. 4/ Mecanisme séquencé avec NADP+ comme substrat directeur et NADPH comme dernier substrat.
Question
2 Domaine 1 = domaine de fixation de NADPH, domaine 1 = domaine catalytique. K65 (Lysine): stabilise le groupe carboxyle du Dshi. caractère hydrophobe de l'interaction du domaine de fixation du NADPH et du domaine catalytique.
Liens utiles:
- Enzymologie-enzymes (exercices)
- QCM-Enzymes. Structure et fonction (bases)
- Hexokinase
- Coenzyme A transférase
- Amine oxydase
- Inhibiteurs. Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Phospholipase, Allostérie
- Citrate synthétase, Peroxydase (Examen)
- Chélatase, Aspartate transcarbamylase. Examen
- Polyphénoloxydase. Examen
- Enzymologie. Examen 5
- Carboxylestérase, PAL. Examen S5, 2013
- Pyrophosphorylase,
Méthylestérase. Examen S5, 2013



Ouvrages de la préparation de la transition Secondaire-Supérieur


-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
BIOCHIMIE. TP CONSIGNES (Vidéos)
Chaine Youtube (abonnement). Plusieurs vidéos multilingues

ANNONCES, INFORMATIONS
Congrès, Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo annonces
CONCOURS:
Concours de Pharmacie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.